经过多年努力,宋玉军教授团队近期在现代物理技术与生物医学工程及中药现代化领域的交叉创新研究上取得一定进展。团队从纳米药物智能化抗肿瘤效果的分子结构设计出发,研制出国际上首款系列化有机无机复合多模靶向控释纳米中药,在肝部肿瘤治疗上疗效显著,成果相继发表在Small、Chem Mater、Acta Biomaterialia等领域期刊上。
此类多模靶向纳米药物的核心是具有多模影像(可见光到红外(OI)、磁共振成像(MRI)、计算机辅助X光断层扫描(CT)等)功能的异质结构纳米粒子(如Au@CoFeB、Fe@FeOx)和中药有效成分(如人参皂苷Rg3)。其中异质结构纳米粒子采用发明的程序微流体方法可控合成,进而采用发明的双硅烷表面改性成分激活共扼偶联法制备,构建水动力学半径约200-400nm的纳米药物聚集体。该纳米药物聚集体具有自主靶向肿瘤微环境因子(如pH、温度)、开展集团军多兵种联合作战抗肿瘤的效果。在一定剂量下,这些纳米药物在肝癌和血癌治疗上效果显著,且对正常的血管上皮细胞和免疫细胞基本无毒副作用,且有激活机体免疫系统和远端效应抗肿瘤复发和转移的功能,同时具有光动、光热、磁动、磁热等理化消融和调节肠道菌落抗肿瘤的效果;还可以可视化研究抗肿瘤疗效和机理。
最近团队在突破化学动力学疗法(CDT)临床应用的关键技术瓶颈“用药安全性和药物有效利用率”以及实施多模成像、靶向肿瘤微环境(TME)、同步激活铁死亡-凋亡双重机制抑制肿瘤方面又取得创新成果。研究成果以“Dynamic ginsenoside-sheltered nanocatalysts for safe ferroptosis-apoptosis combined therapy”为题,在Acta Biomaterialia上在线发表,https://doi.org/10.1016/j.actbio.2022.08.026。(*CDT激活细胞凋亡是一种潜在的抗癌策略,但其具有严重的毒副作用以及治疗效率低等问题,严重制约其临床医学转化。)
团队在前期工作(Z Ren, et al., Small 16(2020)1905233; W Zhang, et al., Chem Mater 32(2020)5044; Zhao X, et al, Nanoscale Adv 4(2022)190)基础上,以发展胰腺癌治疗用多模靶向纳米药物为例开展该项研究,设计并使用上述发明的程序微流体和双硅烷共轭偶联方法制备出具有MRI和CT影像功能的纳米中药FePt@FePtOx-Rg3(NFPR);进而通过离体细胞和活体动物实验对其细胞毒性、组织毒性、疗效安全性和机理进行研究。通过MRI和CT影像原位示踪治疗过程中药代动力学,结合治疗过程中准原位的生化指标、组织器官病理切片等分析,揭示其提高用药安全性和疗效的机制(图1)。Rg3表面工程后的纳米酶在系统给药后显著改变纳米酶的药代动力学和器官内分布,从而避免了纳米药物中无机核(特别是含毒性比较大的金属如Pt类纳米药物)在抗肿瘤治疗中的毒副作用,有效解决了传统纳米粒子的自主肝富集问题,避免了纳米粒子对肝的损害,极大地提高了纳米药物的生物安全性(图1)。Rg3保护的纳米催化剂在生理环境中具有良好的稳定性,其高亲水表面使其在血液中的循环时间更长,可以在肿瘤细胞铁死亡的Fenton反应激活剂到达肿瘤之前克服对多种内源性因素的易感性,在肿瘤细胞微环境内化后实现特异性释放,积累大量ROS;同时也释放出少量氧气有效克服缺氧,增强肿瘤组织氧化损伤的作用。因此,肿瘤细胞的凋亡和铁死亡同步发生(图2)。NFPR优秀的血液循环能力导致了更多NFPR富集到肿瘤部位,无机核心还可以充当细胞内化载药平台,促进更多的Rg3进入肿瘤细胞内,显著提高了纳米药物整体细胞内化力;纳米药物被内吞后,表面的Fe2+和Fe3+离子在FePt催化下与细胞质中的过氧化氢反应生成大量活性氧同系物(ROS),破坏线粒体和细胞核,在Fe2+的存在下同步激活细胞凋亡和铁死亡,具有显著的有机-无机组份协同抗肿瘤效果(图3)。团队通过活体动物MRI和CT准原位双模成像结合血生化和病理切片染色分析等进一步验证了NFPR在肿瘤处富集促进细胞凋亡和铁死亡双轮驱动的抗肿瘤机制(图4)。
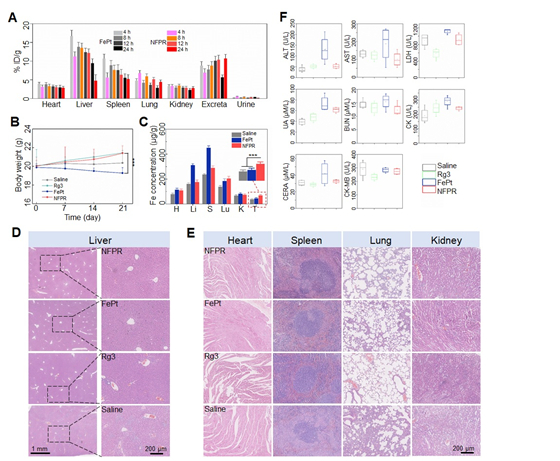
图1 胰腺癌治疗过程中对纳米药物在活体动物不同器官处的病理切片和血生化分析。(A)通过ICP-MS对注射FePt和纳米药物NFPR后在开始不同时间节点处的铁在不同器官处的分布分析;(B) 21天时不同用药组小鼠的体重;(C)注射FePt和纳米药物后21天时不同组织处铁分布分析;(D)不同对照组的肝部H&E染色分析;(E) 不同对照组的其它器官处的H&E染色分析;(F)不同药物处理后21天时肝部的血生化分析。
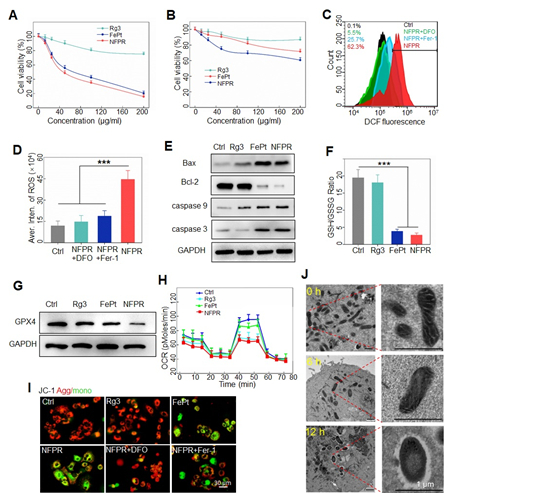
图2 纳米药物NFPR离体细胞毒性和药理研究。(A)不同孵化条件下孕育24小时后L3.6pl胰腺癌细胞的存活率。(B)不同孵化条件下孕育24小时后胰腺正常导管上皮HPDE细胞存活率。(C)通过流式细胞仪双氯荧光黄乙酸乙酯染色分析的不同药物处理L3.6pl细胞24小时后ROS水平。(D)不同给药24小时后经DCFH-DA染色后使用流式细胞仪的定量分析。(E)在不同的药物处理24小时后胰腺癌细胞L3.6pl的免疫印迹实验揭示的细胞凋亡通路bax、bcl-2、谷胱甘肽过氧化物酶-9、谷胱甘肽过氧化物酶-3和DGAPDX铁依赖性细胞固定蛋白水平动力学定量分析。(F)用不同药物处理L3.6pl胰腺癌细胞后谷胱甘肽/氧化型谷胱甘肽比率。(G)不同给药24小时后使用L3.6pl的免疫印迹实验对GPX4水平的分析。(H)不同药物处理后的海马XF24细胞外液分析揭示了L3.6pl 细胞的线粒体功能的OCR。(I)用JC-1对L3.6pl胰腺癌细胞染色后的共聚焦激光扫描显微镜图像。(J)NFPR孵化后不停时间对L3.6pl细胞的线粒体状态变化的生物透射电子显微镜图像。
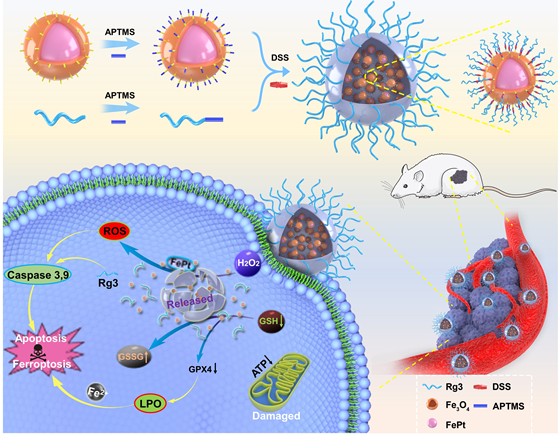
图3 制备多模靶向有机-无机复合纳米中药FePt@FePtOx-Rg3及其各级组份在协同作战治疗胰腺癌中突破CDT疗法中关键瓶颈问题的策略示意图。
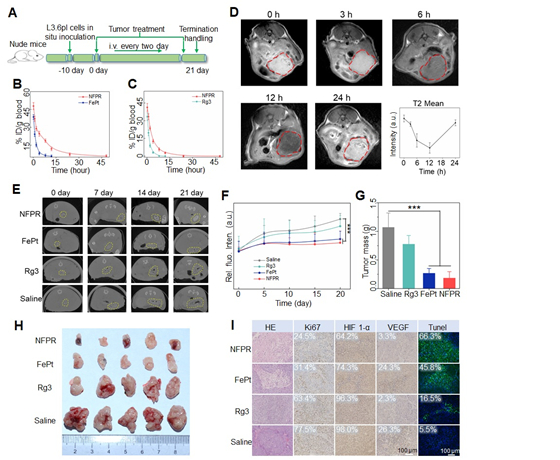
图4 小鼠静脉注射纳米中药FePt@FePtOx-Rg3的成像效果和对其抗癌疗效机制的活体示踪测试。(A)活体动物实验方案。(B)静脉注射FePt纳米粒子和NFPR纳米药物后血浆中Fe浓度时间变化曲线(n=3)。(C)静脉注射Rg3和NFPR纳米药物后血浆中Rg3浓度时间变化曲线(n=3)。(D)静脉注射NFPR纳米药物后肿瘤处MRI的T2WI权重随时间变化曲线(B0 = 7.0 T)。(E)不同药剂给药后在不同时间点(0天、7天、14天、21天)时肿瘤处的CT扫描图像。(F)不同药剂给药后肿瘤部位生物发光图像的定量分析。(G)不同药物处理21天后小鼠肿瘤组织的最后重量(n = 5)。(H)不同用药方式21天后取出的肿瘤离体图像。(I)不同对照组小鼠肿瘤组织切片的H&E、Ki67、HIF 1-α、VEGF和TUNEL染色分析。
为了进一步提高用药安全性,近期团队又设计了高生物相容性的由天然聚合物交联构建的互穿网络多孔水凝胶载药体系,并发明了液滴微流体技术将纳米中药水凝胶胶囊化,具有高效的口服输运和靶向肿瘤微环境控制释放效果,实现了该类纳米药物的口服化(R Liu, et al., RSC Adv 11(2021)37814)
以上研究成果是在国家科技重大专项(2018ZX10301201)、国家自然科学基金国际(地区)合作与交流项目(51862245309)和国家自然科学基金面上项目(51971029)以及杭州睿笛生物科技有限公司和郑州天兆医疗科技有限公司的资助下,和浙江大学陈新华团队和王本团队、厦门大学李文岗团队及哈佛大学David Weitz团队合作完成,12BET为第一完成单位。